Kapitel 2
1. Ein Element hat 64 Nukleonen. Kannst du genau sagen, um welches Element es sich handelt?
2. Ein Element hat die Ordnungszahl 8. Um welches Element handelt es sich? Wie viele Elektronen befinden sich in der Atomhülle dieses Elements?
3. Die Atommasseneinheit u ist mithilfe der Kohlenstoff-Massenskala definiert. Zugrunde liegt dabei genau ein Zwölftel der Masse eines Kohlenstoff-Atoms als Definition für 1 u. Warum aber ist dann im PSE die Atommasse des Elements Kohlenstoff mit 12,011 u angegeben? Gib an, welches feine Detail bei dieser Beschreibung beachtet werden muss!
4. Gleiche die folgenden Reaktionsgleichungen aus:
a) SO2 + O2 → SO3
b) Al + O2 → Al2O3
c) NH4ClO4 → Cl2 + N2 + O2 + H2O
5. Die Angabe eines „Anteils“ bezieht sich immer auf eine Komponente im Verhältnis zur Summe aller Komponenten und in Bezug auf dieselbe Größe. Mit dem Massenanteil lässt sich nicht nur der Anteil eines Stoffes in einer Lösung berechnen. Wir können auch den Massenanteil eines Elementes in einer chemischen Verbindung berechnen.
Welchen Massenanteil an Schwefel hat die Aminosäure Methionin (C5H11NO2S)?
6. Zwei Moleküle der Aminosäure Cystein können sich unter Abspaltung von zwei H-Teilchen zu Cystin verbinden. Schätze aufgrund logischer Überlegung, ohne zu rechnen, ob der Massenanteil von Schwefel in Cystein (C3H7NO2S) oder in Cystin (C6H12N2O4S2) größer ist.
7. Stelle 100 mL physiologische Kochsalzlösung her. Sie enthält 0,9 % (w/v) NaCl in reinem Wasser. Beschreibe dein Vorgehen bei der Herstellung. Wie molar ist die Lösung (Stoffmengenkonzentration in mol · L–1)?
8. Phosphatgepufferte Salzlösung (PBS) kommt bei vielen biologischen Experimenten zum Einsatz. Sie enthält in einem Liter: 8,0 g Natriumchlorid NaCl, 0,20 g Kaliumchlorid KCl, 1,42 g Dinatriumhydrogenphosphat Na2HPO4 und 0,27 g Kaliumdihydrogenphosphat KH2PO4. Alles wird in reinem Wasser gelöst. Berechne die Stoffmengenkonzentration für jede einzelne Komponente.
Eine Zusatzaufgabe: Wie hoch ist die gesamte Stoffmengenkonzentration von Cl-Teilchen in der Lösung? (Du wirst in den folgenden Kapiteln lernen, dass es sich dabei um Chlorid-Ionen handelt).
9. Suche in der Küche (beim Kochen, Backen, Essen, Trinken) nach homogenen und heterogenen Gemischen!
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
Kapitel 3
1. Die ideale Gaskonstante R hat den Wert 8,31446218. Die Einheit der Gaskonstante lautet J ⋅ mol−1 ⋅ K−1. Leite dir zur Übung aus der idealen Gasgleichung diese Einheit her. (Tipp: 1 J = 1 N ⋅ m)
2. Bei welcher Temperatur wird ein ideales Gas flüssig?
3. Ein ideales Gas in einem geschlossenen System hat einen Druck p1 von 1 bar und eine Temperatur T1 von 165 °C. Welchen Druck hat das Gas, wenn du unter isochoren Bedingungen die Temperatur um 20 K erhöhst?
4. Warum trocknet Wäsche im Winter bei 5 °C auf der Leine, obwohl der Siedepunkt für Wasser 100 °C beträgt?
5. Mach eine kleine Lernpause und trink einen Tee. Damit die Pause nicht zu lang wird, sorge durch Pusten dafür, dass der heiße Tee möglichst schnell eine angenehme Trinktemperatur erreicht. Nebenbei kannst du ja mal auf der Teilchenebene erklären, warum der Tee dadurch schneller abkühlt.
6. Errechne das Molare Volumen eines idealen Gases unter SATP-Bedingungen.
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
Kapitel 4
1. Wer viel lernt, braucht auch Lernpausen. Außerdem lernt es sich gemeinsam in einer möglichst gemütlichen Atmosphäre am besten. Also ruf doch ein paar Freunde an und trefft euch am Abend. Ihr werdet genug Gesprächsstoff haben, um euer chemisches und physikalisches Verständnis zu prüfen und zu schulen.
2. Prüfe dein Verständnis:
- Wie verhält sich die Löslichkeit von Gasen mit der Temperatur. Lösen sich Gase besser in kalter oder in heißer Flüssigkeit?
- Was ist ein azeotropes Gemisch?
- Sind miteinander lösliche Stoffe unter allen Umständen miteinander homogen mischbar?
- Warum erhöht sich der Siedepunkt einer Salzlösung im Verhältnis zu reinem Wasser?
- Was ist Osmose? Erkläre, warum Salatblätter matschig werden, wenn sie zu lange in der sehr salzhaltigen Salatsoße lagen. Tipp: Betrachte die Zellwände der Pflanzenzellen als semipermeable Membran.
- Gibt es heterogene Gasgemische?
3. Drei Gase A, B und C befinden sich als Gasgemisch in einem geschlossenen Raum. Die Stoffmenge von Gas A beträgt n(A) = 1 mol, die von Gas B beträgt n(B) = 0,8 mol und die von Gas C beträgt n(C) = 2,5 mol. Nimm an, dass es sich um ideale Gase handelt.
a) Berechne den Partialdruck der Gaskomponente B, wenn der Gesamtdruck 101,3 kPa beträgt.
b) Welches Volumen nimmt das gesamte Gasgemisch ein, wenn die Temperatur 0 °C beträgt?
4. Im Blutplasma des arteriellen Blutes ist Sauerstoff mit einem Partialdruck von ca. 95 mmHg gelöst. Für Kohlenstoffdioxid beträgt der Partialdruck im arteriellen Blut ca. 40 mmHg. Welche der folgenden Aussagen ist oder sind korrekt?
a) Es ist mehr als doppelt so viel Sauerstoff im Blutplasma gelöst wie Kohlenstoffdioxid.
b) Wenn arterielles Blutplasma frei im Kontakt mit Luft wäre (Luft-Partialdruck von CO2 bei ca. 0,3 mmHg), wäre zu erwarten, dass CO2 aus dem Blut entweichen würde.
c) Stünde das Blutplasma (gedacht als wässrige Lösung) im Gleichgewicht mit einem darüber befindlichen Gasraum, würde der Partialdruck von Sauerstoff im Gas ebenfalls ca. 95 mmHg betragen und der Partialdruck von Kohlenstoffdioxid ca. 40 mmHg.
5. Der Volumenanteil von Stickstoff, Sauerstoff und Kohlenstoffdioxid in der Luft beträgt V(N2) = 78,1 %, V(O2) = 20,9 % und V(CO2) = 0,04 %. Berechne, wie hoch die Konzentration dieser drei Gase in Wasser wäre, wenn die Luft bei normalem Atmosphärendruck und 25 °C im Gleichgewicht mit der wässrigen Lösung steht. (Tipp: Wichtige Angaben, die du zur Lösung benötigst, findest du im Text).
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
Kapitel 5
1. Nimm dir ein wenig Zeit und lass die Inhalte dieses Kapitels noch einmal Revue passieren. Am besten schnappst du dir ein Familienmitglied, Freund/Freundin, Mitbewohner*in oder notfalls das Haustier und erklärst mit eigenen Worten, wie man sich den Aufbau von Atomen und ihrer Elektronenhülle vorstellt. Dann erkennst du am besten, ob du es verstanden hast.
2. Erläutere stichpunktartig, warum die Vorstellung von Elektronen, die auf einer Kreisbahn um den Atomkern fliegen, nicht ausreichend ist, um die Elektronhülle eines Atoms zu beschreiben.
3. Prüfe dein Verständnis:
a) Wie viele verschiedene räumlich abgrenzbare Orbitale sind in Tab. 5.1 aufgelistet?
b) Wie viele verschiedene Quantenzustände sind in der Tabelle aufgelistet?
c) Wie viele Orbitale gibt es in der Schale mit der Hauptquantenzahl n = 2?
d) Bestimme, wie viele Orbitale es in der Schale mit der Hauptquantenzahl n = 4 geben muss!
4. Ordne die folgenden Elektronenkonfigurationen ihren Elementen zu (nach dem Aufbauprinzip, nicht schummeln!):
a) [Ar]4s2
b) [He]2s22p4
c) [Ne]3s23p1
d) 1s22s22p63s23p1
e) [Ar]4s23d6
5. In eine bestimmte Schale des Atomorbitalmodells (gleiche Hauptquantenzahl n) passen immer maximal 2n2 Elektronen. Prüfe für n = 1 bis n = 4, ob diese Aussage korrekt ist.
6. Welche der folgenden Orbitale sind kugelsymmetrisch?
a) 3s
b) 2px
c) 1s
d) 3dxy
7. Welche der folgenden Orbitale haben in einem Atom das gleiche Energieniveau?
a) 1s und 3s
b) 3px und 2px
c) 3px und 3dxy
d) 2px und 2pz
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
Kapitel 6
1. Denksportaufgabe: Die erste Ionisierungsenergie für Natrium ist deutlich niedriger als die erste Ionisierungsenergie für Neon. Überlege dir, ob die zweite Ionisierungsenergie für Natrium höher oder niedriger ist als die erste Ionisierungsenergie für Neon.
2. Nenne mindestens zwei Ionen, die zum Edelgas Neon isoelektronisch sind.
3. Falls du der Anweisung im Text noch nicht gefolgt sein solltest, verdonnern wir dich jetzt noch einmal dazu: Leite dir die Trends für die Kovalenzradien und die Ionenradien innerhalb einer Periode und innerhalb einer Hauptgruppe her!
4. Welches Anion ist leichter polarisierbar? Fluorid oder Iodid?
5. Welches Atom zieht in den folgenden Molekülen die Elektronen stärker zu sich? Zeichne die Valenzstrichformeln:
a) NH4+
b) H2O
c) CO
d) HF
6. Zeichne die Valenzstrichformeln der folgenden Verbindungen! Achte auf Besonderheiten wie mesomere Grenzstrukturen, Hypervalenz und Radikale:
a) NO2
b) NO3−
c) SO42−
d) CN−
e) PO43−
7. Welche der Verbindungen aus Aufgabe 5 kann Wasserstoffbrückenbindungen ausbilden?
8. Was versteht man unter dem Begriff „partieller Doppelbindungscharakter“? In welchem Zusammenhang taucht dieser Begriff auf?
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
Kapitel 7
1. Nimm dir ein Blatt Papier und zeichne ein großes, gleichseitiges Dreieck. Verbinde die Mittelpunkte der Seitenlinien des Dreiecks miteinander. Jetzt hast du vier gleichseitige Dreiecke vorliegen. Zeichne noch Kleberänder, schneide aus und falte zu einem Tetraeder. Präge dir diese Figur ein, sodass du sie dir genau vorstellen kannst. Überlege dir drei Verbindungen, in denen eine Tetraeder-Anordnung an einem Atom vorliegt.
2. Such in Büchern oder im Internet nach der Struktur von 1-Butanol. Überlege dir, welche Isomere es bei gleicher Summenformel geben kann. Gib für jedes Atom im Molekül an, welche Orbitalhybridisierung vorliegt.
3. Gibt es für folgende Moleküle Konformationsisomere?
a) Methan
b) Ethen
c) Ethan.
4. Zeichne das Orbitaldiagramm für die Bildung von H2. Prüfe deine Lösung anschließend anhand von Abb. 7.4.
5. Welche räumliche Struktur hat nach der VSEPR-Theorie das Nitrat-Ion NO3− ? Begründe diese Struktur anhand der
Orbitalhybridisierung.
6. Welche der folgenden Moleküle weisen eine Elektronendelokalisation in den p-Orbitalen über mehrere π-Bindungen hinweg auf?
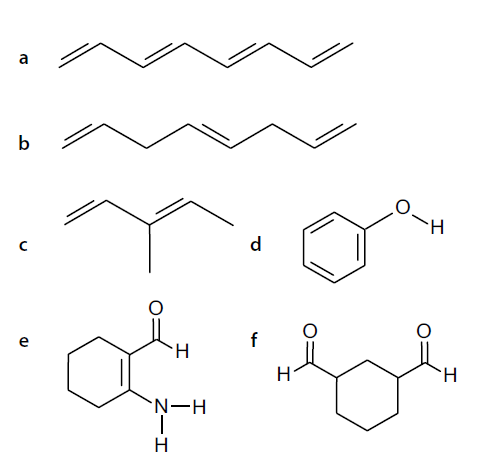
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
Kapitel 8
1. Zeichne die folgenden funktionellen Gruppen als Valenzstrichformeln (wenn nötig, mit Mesomerie) auf. Erkläre ihre räumliche Struktur anhand der Elektronenstruktur ihrer Bindungen: Hydroxyl-Funktion, Carboxyl-Funktion, Amino-Funktion, Aldehyd-Funktion
2. In Abb. 8.3 ist der sekundäre Alkohol 2-Butanol abgebildet. Beim primären Alkohol 1-Butanol ist die Hydroxylfunktion endständig, so wie bei 1-Propanol. Überlege dir, ob 2-Butanol einen höheren oder niedrigeren Siedepunkt hat als 1-Butanol.
3. Kennzeichne in dem in Abb. 8.8 gezeigten Amid (1-Aminopropylpropansäureamid) das α-C-Atom der zugrunde liegenden Carbonylverbindung. Welche ist es?
4. Eine Verbindung bestehe aus einer Kohlenwasserstoff-Kette mit 7 C-Atomen. Genau in der Mitte sei ein H-Atom durch eine Hydroxylfunktion ersetzt. Zeichne die Struktur und benenne sie nach den systematischen Regeln.
5. 2-Penten trägt eine Doppelbindung zwischen dem 2. und 3. C-Atom der Kette von Pentan. Ist mit dem Namen 2-Penten allein die Verbindung eindeutig beschrieben? Begründe!
6. Wie viele Konfigurationsisomere gibt es von 3-Pentanol (auch Pentan-3-ol)?
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
Kapitel 9
1. Notiere in der Skelettschreibweise (vgl. Abb. 9.2 links) eine Oligopeptidkette mit folgender Primärstruktur: Met-Tyr-Lys-Ala.
2. Um was für eine funktionale Proteinklasse handelt es sich vermutlich bei dem Makromolekül namens „DNA-Polymerase“?
3. Eine Reihe von Enzymen aus der Gruppe der „Serin-Threonin-Kinasen“ nimmt an Signaltransduktionsprozessen in Zellen teil. Welche Modifikation nehmen diese Enzyme an Serin- und Threoninresten vor? Was haben Serin und Threonin dafür gemeinsam?
4. Eine weitergehende Aufgabe für dein Selbststudium: Finde heraus (andere Bücher, Internet), was es bedeutet, wenn man von einer Omega-3-Fettsäure spricht. Welches der in Abb. 9.7 dargestellten Phospholipide enthält eine Omega-3-Fettsäure?
5. Leite dir aus den Fischer-Projektionen der Galactose und Mannose ab, wie diese Moleküle als normale (Keilstrich-)Strukturformel gezeichnet werden müssten. Leite dann anhand der Strukturformeln die Haworth-Formeln für α- und β-Galactose und α- und β-Mannose her.
6. Im Disaccharid Trehalose sind zwei Glucosemonomere α-1,1-glycosidisch verknüpft. Zeichne die Haworth-Formel für Trehalose.
7. Finde heraus, wozu der Prozess des Mälzens bei der Herstellung von Bier dient.
8. Vergleiche den Aufbau eines Nukleosids mit dem eines Nukleotids.
9. Eine gedachte DNA besteht zu etwa 15 % aus Nukleotiden mit der Base Cytosin. Berechne den Anteil der anderen Basen!
10. Die Wasserstoffbrückenbindungen und Stapelkräfte zwischen einzelnen Basen der DNA sind verhältnismäßig klein. Begründe, warum die DNA-Doppelhelix trotzdem eine so stabile Struktur ist.
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
Kapitel 10
1. Das Auflösen einer Brausetablette mit Zitronensäure H8C6O7 ist auf folgende Reaktion zurückzuführen:
H8C6O7 + CaCO3 → Ca3(H5C6O7)2 + CO2 + H2
Gleiche die Reaktion stöchiometrisch aus.
2. Hier noch mehr Reaktionsgleichungen zum Ausgleichen. Jippieh!
FeS + O2 → Fe3O4 + SO2
Ca(OH)2 + CO2 → CaCO3 + H2O
Mg + CO2 → MgO + C
C6H12O6 + O2 → CO2 + H2O
3. Stelle das MWG mit der Gleichgewichtskonstanten Kc für die folgenden drei Reaktionen auf:
2 Ag2O(s) ⇌ 4 Ag(s) + O2(g)
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
4 HCl(g) + O2(g) ⇌ 2 Cl2(g) + 2 H2O(l)
4. Im Körper spielt das Gleichgewicht zwischen Adenosinmonophosphat (AMP), Adenosintriphosphat (ATP) und Adenosindiphosphat (ADP) eine wichtige Rolle:
AMP+ATP ⇌ 2ADP
Die Gleichgewichtskonstante Kc beträgt für diese Reaktion 1. Berechne die Konzentration von ADP, wenn 0,01 mmol ⋅ L-1 AMP und 1 mmol ⋅ L–1 ATP im Gleichgewichtszustand vorliegen.
5. Eine Chemikerin möchte aus einem chemischen Gleichgewicht eine möglichst große Ausbeute eines Stoffes gewinnen. Die Reaktion, bei der der Stoff entsteht, ist exotherm, und die Teilchenzahl vergrößert sich im Zuge der Entstehung des Stoffes. Nenne drei Möglichkeiten, die die Chemikerin hat, um die Ausbeute zu maximieren!
6. Das Löslichkeitsprodukt für BaSO4 ist 10–10 mol2 ⋅ L–2. Wie groß ist sein pKL-Wert? Ist eine Lösung denkbar, in der 10–4 mol ⋅ L–1 MgSO4 und 10–4 mol ⋅ L–1 BaCl2 gelöst sind (unter Vernachlässigung des Einflusses fremder Ionen auf die Löslichkeit)?
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
Kapitel 11
1. Geh durch deine Wohnung/WG und versuche, so viele Orte/Geräte wie möglich zu finden, an denen Energie von einer Form in eine andere umgewandelt wird.
2. Könnte dein Fahrrad nicht mal wieder etwas Luft auf die Reifen gebrauchen? Schnapp dir eine Luftpumpe und verrichte Volumenarbeit.
3. Bestimme die Reaktionsenthalpie für die Verbrennung von Ethin:
2C2H2 + 5O2 + 4CO2 + 2H2O
∆H0f(C2H2) = 227 kJ ∙ mol-1
∆H0f(CO2) = -394 kJ ∙ mol-1
∆H0f(H20) = -286 kJ ∙ mol-1
4. Überprüfe unsere Aussage über die Lösungsenthalpie von Kochsalz. Wir haben gesagt, sie ist leicht positiv (4 kJ · mol−1). Löst sich Kochsalz besser in warmem oder kaltem Wasser?
5. Führe (auf eigene Verantwortung) einen Selbstversuch zur Entropie durch: Wende eine Woche lang keine Arbeit bzw. sonstige Energie auf, um einen bestimmten Teil deiner Wohnung/deines Schreibtisches ordentlich zu halten. Dadurch solltest du leicht herausfinden können, ob die Annahmen, die wir zur Entropie getroffen haben, richtig oder falsch waren.
6. Berechne die freie Enthalpie der Verbrennung von Alkohol mit Sauerstoff bei Standardbedingungen:
CH3CH2OH(1) + 3O2(g) → 2CO2(g) + 3H2O(1)
Angaben: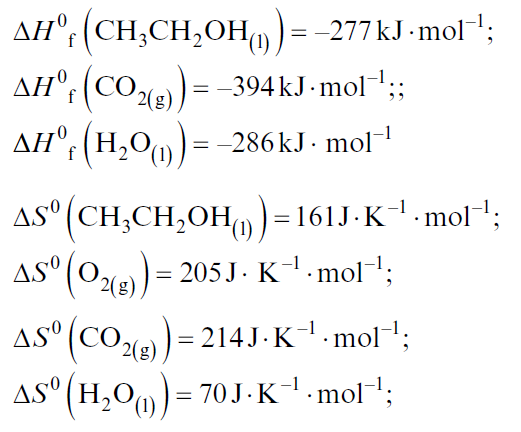
7. Eine weitere Reaktion der Glycolyse ist die Bildung von 3-Phosphoglycerat aus 1,3-Bisphosphoglycerat:
1,3 - BPG + H2O → 3 - PG + Pi
∆G0R(C2H2) = -49,1 kJ ∙ mol-1
Das entstehende Phosphat wird dabei auf ADP übertragen und es wird ATP gebildet. Berechne die freie Reaktionsenthalpie für die gekoppelte Gesamtreaktion mithilfe der Angaben für die Bildung von ATP aus Abschn. 11.4.2:
1,3 - BPG + ADP → 3 - PG +ATP
∆G0R = ?
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
Kapitel 12
1. Die Geschwindigkeit der Zerfallsreaktion A → B + C ist nur von der Konzentration von A abhängig.
a. Stelle das Geschwindigkeitsgesetz für diese Reaktion auf.
b. Welche Durchschnittsgeschwindigkeit hatte die Reaktion, wenn in einem Liter Wasser 0,05 mol A in zwei Sekunden
zerfallen sind?
c. Welche Geschwindigkeit hat die Reaktion gerade dann, wenn 0,2 mol ·L−1 von A vorhanden sind? Die Geschwindigkeitskonstante k hat einen Wert von 2 s−1.
2. Die Reaktion A + B → C erfolgt, wenn jeweils ein Teilchen von A und B zusammenstoßen.
a. Stelle das Geschwindigkeitsgesetz für diese Reaktion auf.
b. Welche Konzentration von A liegt vor, wenn die Konzentration von B 1 mol · L−1 beträgt und die Geschwindigkeit 0,4 mol · L−1 · s−1 ist? (k = 0,1 L · s−1 · mol−1)
3. Die Reaktion SO2Cl2 → SO2 + Cl2 läuft nach einem Geschwindigkeitsgesetz erster Ordnung ab, während die Reaktion
NO2 → NO + 1/2 O2 einem Geschwindigkeitsgesetz zweiter Ordnung folgt. Stelle für beide Reaktionen das Geschwindigkeitsgesetz
bezüglich der Edukte auf.
4. H2O2 hat bei einer Wellenlänge von 240 nm einen Absorptionskoeffizient ε240 von 0,0394 L · mol−1 · cm−1. Welche Konzentration hat demnach eine H2O2-Lösung, die in einem Photometer mit der Küvettenbreite 1 cm eine Absorption von 3,94 · 10−3 aufweist?
5. Ein Enzym besitzt die Michaelis-Kontante KM = 5 mmol · L−1, und die von ihm katalysierte Reaktion hat bei einer Substratkonzentration von 2 mmol · L−1 eine Anfangsgeschwindigkeit von 0,029 mmol · L−1 · s−1. Wie groß ist die Maximalgeschwindigkeit für die katalysierte Reaktion?
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
Kapitel 13
1. Schreibe die konjugierten Säuren bzw. Basen der folgenden Verbindungen auf:
HCl; H2PO4−; HNO3; H2CO3; CO32−; NH3
2. Berechne den pH-Wert einer 0,01-molaren HCl-Lösung und den einer 0,01-molaren Essigsäurelösung (pKS 4,75).
3. Berechne pH-Wert einer 0,01-molaren NaOH-Lösung.
4. Welche Konzentration an Acetat-Ionen (Ac−) liegt in einem Essigsäure-Acetat-Puffer vor, wenn 0,0001 mol ⋅ L–1 Essigsäure vorhanden sind und der pH-Wert bei 6 liegt?
5. Lewis-Base oder Lewis-Säure:
H2O, PF5, NH3, H+, OH−?
6. Beurteile nach dem HSAB-Konzept, ob folgende Verbindungen eher stabil oder eher instabil wären:
Fe(CN)3; Al2O3; HF; CuNO3; AuCN; Fe(OH)3; PbSO4
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
Kapitel 14
1. Schaue dir in einem Biologie Lehrbuch oder im Internet die Atmungskette in der Membran bei der Zellatmung an und versuche herauszufinden, wann welcher Stoff oxidiert bzw. reduziert wird.
2. Nimm dir ein Periodensystem der Elemente und versuche, für die Elemente der ersten drei Perioden die möglichen Oxidationszahlen zu ermitteln. Zum Überprüfen deiner Ergebnisse schau in Abb. 14.4 nach.
3. Aus welchen Gründen ist es unsinnig, eine Batterie mit einer Standard-Wasserstoffelektrode zu betreiben?
4. Ermittle für die folgenden Verbindungen die Oxidationszahlen der beteiligten Elemente (wenn möglich aus der Summenformel):
NH4+, MgF2, CH4, H3O+, CN-, NO2-, N2, CH3CH2COOH, C6H12O6
5. Das Tripeptid Glutathion GSH (Kap. 9) besitzt eine freie -SH Gruppe. Im Zuge der zellulären Entgiftung kann es helfen, Proteine und Membranlipide vor reaktiven Sauerstoffspezies zu schützen. Dabei reagieren zwei Glutathionmoleküle über ihre -SH Gruppen miteinander zu GSSG und es findet eine Oxidation statt. Weise anhand der Oxidationszahlen des Schwefels in GSH und GSSG nach, dass eine Oxidation stattgefunden hat.
6. Gleiche die Redox-Reaktion von Iod und Salpetersäure im sauren Milieu aus:
I2(aq) + HNO3(aq) → 2IO3(aq)- + NO(aq)
7. Berechne die Potenzialdifferenz einer galvanischen Zelle mit den Halbzellen Na+/Na (c = 0,1 mol · L−1) und Fe3+/Fe2+ (c = 0,01 mol · L−1).
8. Rechne für das galvanische Element aus Aufgabe 7 die freie Enthalpie aus, wenn die Konzentrationen aller gelösten Komponenten 1 mol · L−1 betragen.
Die Lösungen zu den Übungsaufgaben sind im pdf am Ende der Seite zu finden.
